首页 > bFGF基因转染的牙龈成纤维细胞与脱细胞真皮基质复合物的体外构建
bFGF基因转染的牙龈成纤维细胞与脱细胞真皮基质复合物的体外构建
发布时间:[2014-05-23]
福建医科大学学报2010年8月第44卷第4期
bFGF基因转染的牙龈成纤维细胞与脱细胞真皮基质复合物的体外构建
刘崇武,陈欣戬,李艳芬,闫福华
【摘 要】
目 的:研究碱性成纤维细胞生长因子(bFGF)基因修饰的牙龈成纤维细胞(GFs)与组织工程支架材料脱细胞真皮基质(ADM)复合后的生长、结合情况,为基因治疗与组织工程联合应用于牙周组织缺损再生治疗提供依据。
方 法:将转染bFGF的GFs接种于ADM 真皮面,通过荧光显微镜、激光共聚焦扫描显微镜、透射电镜及组织学检查,观察细胞的生长状况及其与支架材料的复合情况。
结 果:基因修饰的牙龈成纤维细胞复合ADM膜后生长良好,24 h细胞已贴附、伸展。透射电镜可见细胞在支架材料中生长,并与支架材料结合紧密。
结 论:转染bFGF基因的的GFs与ADM 膜复合物有望应用于牙周组织工程。
关键词 成纤维细胞生长因子2;牙周组织;牙龈;成纤维细胞;基因疗法;转染;组织工程;细胞外基质;真皮
随着基因强化组织工程技术研究的深入和发展,实现牙周组织的完全再生将成为可能。基因强化组织工程技术是结合基因工程技术与组织工程学的原理和方法的一种新兴的组织工程方法。其中细胞-支架材料复合物的体外培养是其研究的重要内容之一,细胞必须依赖于细胞外基质才能发挥其正常作用和功能,因此对其替代物—— 支架材料/细胞外基质材料的选择也是基因强化组织工程技术研究的一个重要内容。本研究在前期研究[1] 的基础上将牙龈成纤维细胞(gingival fibroblasts,GFs)转染人碱性成纤维细胞生长因子(human bas—ic fibroblast growth factor,hbFGF)基因,并与脱细胞真皮基质(acellular dermal matrix,ADM)复合,观察转染细胞在ADM 上的附着生长情况,并检测其生物相容性,以期为转染细胞的ADM 复合物在牙周组织工程中的应用提供实验依据。
一、材料与方法
1. 动物及材料: 成年雄性Beagle犬1只,体质量1O kg。由四川省医学科学院四川省人民医院实验动物研究所提供[许可证号:SCXK(川)2004—15]。DMEM
(美国Gibco公司),胎牛血清(美国Hyclone公司),脱细胞真皮基质(脱细胞异体真皮,北京桀亚莱福生物技术有限责任公司),pIRES2一EGFP—hbFGF真核转染质粒由本实验室构建〔1〕。
2. GFs的培养及基因转染: 成年雄性Beagle犬以氯胺酮(40 mg/kg)肌内注射麻醉,全麻下口腔常规手术消毒铺巾,无菌条件下切取上颌第2,3,4前磨牙的游离龈,无菌PBS(含双抗,青霉素100∪/mL,链霉素100μg/mL)冲洗4遍,将组织块剪碎至1 mm×1 mm×1 mm,0.25% 胰酶+0.1% EDTA 37℃消化2 h,离心后去上清,加入含1O% FBS的DMEM,接种于6孔板并覆盖盖玻片,置于37℃ 、体积分数为0.05的CO2 培养箱培养,每隔3 d换液,倒置显微镜下观察细胞形态及生长情况,待细胞在组织块周围长成多个“集落”(接种1 5 d左右),使用无菌镊揭去盖玻片,用0.25% 胰蛋白酶+0.1% EDTA原孔消化。继续培养细胞生长融合后,按1:3进行细胞传代。转染前24 h以每孔2×lO5 的密度将第四代GFs接种于6孔板中,37℃、体积分数为0.05的CO2 饱和湿度培养至呈8o% 融合时转染。应用本实验室构建的plRES2一EGFP—hbFGF真核转染质粒进行转染,转染LipofectamineTM2000使用说明书进行。
3. 支架材料的准备: ADM膜为规则的三维网状支架结构,呈乳白色,微泛红色,柔韧,厚度约1 mm左右。真皮面外观光滑、折光性强,可见明显毛孔,而上皮面则较粗糙,可见皮纹。实验时将材料制备成5 mm×5 mm大小,置24孔板内DMEM培养液浸泡3 h后,弃去培养液,于培养箱中静置30 min后接种细胞。
4. 转染Beagle犬GFs与ADM 材料复合: 0.25% 胰蛋白酶+0.1%EDTA将转染2 d的第四代细胞消化后,调整细胞密度至l×105 mL-1 ,接种于已预湿的ADM,每块接种30 μ L,置于37 ℃孵箱中,2 h后加入适量DMEM 培养液继续培养。隔日换液。
5.荧光显微镜观察按上述方法将细胞接种于ADM,培养3 d后,荧光显微镜观察转染细胞与ADM 的附着情况。
6. 组织学检查: 按上述方法将细胞接种于ADM,培养3 d后取出细胞材料复合物,PBS冲洗两遍,4 %多聚甲醛固定,脱水,常规石蜡包埋、切片,H—E染色,二甲苯透明,封片。
7. 激光共聚焦扫描显微镜观察: 按上述方法将细胞接种于ADM,培养1 d后,将细胞材料复合物取出,PBS冲洗两遍,4% 多聚甲醛固定,激光共聚焦扫描显微镜分层扫描观察,激发波长为488 nm。
8. 透射电镜观察 按上述方法将细胞接种于ADM,培养5 d后取出细胞材料复合物,3 %戊二醛一1.5% 多聚甲醛前固定,1% 锇酸一1.5% 亚铁氰化钾后固定,酒精-丙酮脱水,环氧树脂618包埋剂包埋;超薄切片,醋酸铀、柠檬酸铅染色,透射电镜观察。
二、结果
1. 荧光显微镜观察 : 细胞接种1.5 h后可见部分圆形细胞贴壁.,24 h后细胞部分伸展开。荧光显微镜下可见发出绿色荧光的细胞附着于ADM 膜上,部分细胞呈纤维样(图1)。

2. 组织学观察: 细胞与材料复合培养3d后,可见细胞在其表面单层生长(图2)

3. 激光共聚焦显微镜观察: 在激光共聚焦显微镜下,24 h后可见ADM 表面50μm 下可见发出绿色荧光的细胞,与ADM 紧密结合(图3)。

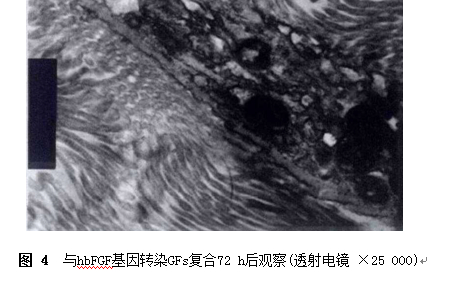
4. 透射电钳观察: 转染hbFGF基因3 d的GFs与材料复合培养3 d后,透射电镜可见细胞能够在支架材料中生长,并与支架材料紧密结合(图4)。
三、讨 论
基因强化组织工程技术主要是通过支架材料将可以表达目的基因的被转染细胞传送到特定的组织中,从而促进组织的修复和再生,因此支架材料在其中起着非常重要的作用。作为基因强化组织工程技术的细胞支架,不仅要求具有良好的生物相容性,不会因物理化学或生物性质的变化而引起不良的组织反应,而且还要求有良好的细胞亲和性,不会引起细胞变性及不影响细胞生长、传代。ADM 是最近几年出现的一种天然生物材料,I型胶原纤维构成其基本骨架,并赋予组织一定的强度和柔韧性。早期作为真皮替代物,由于其去除了引发宿主排斥反应的细胞成分,完整地保留了细胞外基质的形态结构和组成成分,力学机械性能好,抗原性低,可诱导具有再生能力的成纤维细胞、表皮细胞、血管内皮细胞按照应有的组织学方式长入真皮层,其临床应用已取得较好效果,并且在体内的降解吸收与宿主组织改建相一致,已在神经外科、耳鼻咽喉、烧伤整形、牙周等学科领域展开了广泛的研究[2-5 ]。
ADM 可分为异体和异种两类,由于其完整地保留了真皮乳头层表面的基底膜,因此可以为移植细胞的新生和扩展提供支持,为成纤维细胞提供良好的支架,具有调节、诱导、促进宿主细胞长人的作用,也可促进成纤维细胞增生、新生血管和上皮形成。Gustafson和Kratz将全层皮肤用Dispase酶解,分离出真皮,并用TritonX-100去除真皮内细胞,然后将培养的角蛋白细胞移植于其上,最后移植到创面上,发现移植物能刺激创面再表皮化、成纤维细胞长入和血管形成[6]。
Medalie等将人角蛋白细胞和ADM 复合后移植到裸鼠体内,术后1周通过组织学观察发现,来自鼠的成纤维细胞和血管内皮细胞已侵入ADM,且复合物上的薄层角蛋白细胞已分化成薄层表皮[7]。Takami等将大鼠的ADM 异体移植后发现,术后l~2周已完全血管化并伴随有成纤维细胞的浸润[8]。
ADM 作为人工真皮支架已应用于临床,其优良的生物相容性和组织细胞的诱导功能,说明其具有很高的临床应用价值,可作为口腔黏膜缺损的新型修复材料推广使用,表明其为改善组织缺损的愈合提供了一种新的选择[9]。血管化是ADM 组织改建的基础和前提,因此加快ADM 血管化,对提高ADM 支架的实用性有着重要的临床意义[8]。有研究发现,成纤维细胞可以分泌多种细胞外基质和生长因子,从而诱导表皮细胞、内皮细胞增殖。利用成纤维细胞的这种特性,将成纤维细胞植于人工支架上,可以降低排异反应,增加生物亲和性,促进创面肉芽组织生长[10] 。因此,在人工替代物中引入成纤维细胞,可提高生物亲和性,加速新生血管形成。本实验中,笔者转染入GFs的目的基因所表达的bFGF是一种广谱的有丝分裂原,同时也是形态发生和分化的诱导因子,对于来源于中胚层的各种细胞均有明显的趋化作用。体外实验表明,其可对GFs的增殖起到促进作用。另外,它可刺激毛细血管内皮细胞迁移和增生,形成毛细血管芽,降解创伤区域的细胞外基质,使毛细血管向创面区域延伸,为损伤组织的修复提供营养等。将转染hbFGF基因的GFs作为种子细胞植入宿主体内,hbFGF基因可在宿主体内完成表达和后加工,这样就可以避免直接使用重组生长因子所带来的半衰期短、在体内极易降解、作为外源性蛋白植入体内可能引起毒性和免疫反应等缺点。因此,转染hbFGF的GFs与ADM 的复合,可能将有效地提高ADM 修复组织缺损的能力,在牙周组织工程中将具有广阔的应用前景。
本研究通过体外构建hbFGF基因转染的GFs与ADM 复合物,观察转染GFs与ADM 的复合情况,为hbFGF基因转染的GFs应用于牙周组织工程提供了实验依据。
结果表明基因修饰的细胞与ADM 复合后24 h,细胞可贴附于材料表面,部分成梭形生长,组织学研究结果也发现复合培养3 d后,转染细胞在ADM 表面生长。而透射电镜结果证实复合培养后细胞与ADM 连接紧密。
上述研究结果提示,ADM 具有良好的生物相容性,可以提供GFs一个安全的附着环境,但ADM与细胞复合物植人体内后,其降解与新生牙周组织形成的速率如何匹配,体内植入后最终能否促进牙周组织再生,尚有待进一步的深入研究。
参 考 文 献
1. 陈欣戬,李艳芬,钟泉,等.人碱性成纤维细胞生长因子真核表达质粒的构建及其在犬牙龈成纤维细胞中的表达[J].牙体牙髓牙周病学杂志,2009,136(6):318—322.
2. Horobin AJ,Shakesheff KM,Woodrow S,et a1.Maggotsand wound healing:an investigation of the effects of secretionsfrom Lucilia sericata larvae upon interactions between humandermal fibroblasts and extraeellular matrix components[J].J Br J Dermatol,2003,148(5):923-933.
3. Haynes DS,Vos JD,Labadie RF.Acellular allograft dermalmatrix for tympanop lasty[J].Curr Opin Otolaryngol Head Neck Surg,2005,13(5):283-286.
4. Gaspar K,Erdei l,Peter Z,et a1.Role of acellular dermal matrix allograft in minimal invasive coverage of deep burn wound with bone exposed-case report and histological evaluation[J].Int Wound J,2006,3(1):51-58.
5. Sallum E A,Nogueira-Filho G R,Casati M Z,et a1.Coronally positioned flap with or without acellular dermal matrix graft in gingival recessions:a histometric study [J]. Am J Dent,2006,19(2):128-132.
6. Gustafson C J,Kratz G. Cultured autologous keratinocytes on acell- free dermis in the treatment of full-thickness wounds[J].Burns,1999,25(4):331-335.
7. Medalie D A,Eming S A ,Tompkins R G ,et a1.Evaluation of human skin reconstituted from composite grafts of cultured keratinocytes and human acellular dermis transplanted to athymic mice[J].J Invest Dermatol,1996,107(1):121-127.
8. Takami Y,Matsuda T,Yoshitake M ,et a1.Dispase/detergent treated dermal matrix as a dermal substitute[J].Burns,1996,22(3):182-190.
9. 李英,杜志刚.脱细胞异体真皮基质口腔黏膜朴片治疗口腔黏膜缺损:随机对照[J].中国组织工程研究与临床康复,2008,12(19):3734-3735.
10. Purdue G F,Hunt J L,Still J M,eta1.A multicenter clinicaltrial of a biosynthetic skin replacement, Dermagraft-TC,compared with cryopreserved human cadaver skin for temporary coverage of excised burn Wounds[J].J Burn Care Rehabil,1997,18(1 Pt 1):52—57.