真皮替代物移植后的血管化过程及组织学变化的实验研究
发布时间:[2011-09-28]
中华烧伤杂志 2005年2月第21卷第1期
真皮替代物移植后的血管化过程及
组织学变化的实验研究
谢卫国,谭红,赵超莉,王晖
【摘 要】
目 的:了解不同种类真皮替代物移植后的血管化过程及组织学变化。
方 法:将21只SD大鼠根据其皮下埋植不同的真皮替代物分为猪脱细胞真皮基质(sADM)组、人脱细胞真皮基质(hADM组)及人工真皮(Integra)组。于埋植后2、3、4、7、10、14、21、30、60、90、120、150、180 d行移植物大体观察,采用免疫组织化学法观察移植物的血管化过程及组织学变化。
结 果:大体观察:术后各组大鼠创口周围皮肤无明显红肿及炎性反应,切口愈合良好,移植物与创面接触紧密。90d后各组移植物不易从体表触及。180d时,部分移植物面积缩小、厚度变薄甚至难以辨认。组织学观察:移植术后2d起可见成纤维细胞、中性粒细胞、淋巴细胞等侵入移植物内,3d时与受床组织连接处可见长入的新生毛细血管芽。30-60d,移植物内形成丰富的血管网。150d后近似正常真皮结构。180后部分移植物有不同程度吸收退化。
结 论:3种真皮替代物移植后均能很快建立与受床组织的血液循环,并长时间存留于创面,但有一定程度的吸收退化。
关键词 皮肤,人工;真皮;移植;组织工程
在大面积Ⅲ度烧伤患者皮肤缺损的修复中,真皮的重建对于提高创面愈合质量、保证永久性创面覆盖具有至关重要的意义[1]。目前真皮重建主要有2个途径,一是采用天然皮肤材料,去除所有活细胞成分仅保留真皮支架,称为脱细胞真皮基质(acellular dermal matrix,ADM) [2];另一方法是利用胶原等材料人工合成真皮类似物[3]。不管是采用哪种材料,真皮移植后的血管化过程及转归都关系到其移植成活率,同时也决定着成活后的功能状态,影响到最终治疗效果。笔者采用目前国内外具有代表性的3种真皮替代物,通过大鼠皮下埋植,观察植入后的血管化过程及组织学变化,以期为ADM的临床应用提供理论和实验依据。
一、材料与方法
1. 真皮替代物的来源及制备:
1.1 猪脱细胞真皮基质(swine acellular dermal matrix,sADM)的制备:将50kg的健康小白猪(湖北省医院实验动物中心)处死后剥取全厚皮肤,用取皮机反取成中厚皮片厚度为0.3~0.4mm)。用体积分数0.1%的新洁尔灭溶液浸泡15min。浸入2.5g/L胰蛋白酶中,4℃、24h后揭去表皮,以Triton-X 100浸泡并置摇床以100r/min摇震48h,置入体积分数0.2%戊二醛15min。磷酸盐缓冲液(PBS)充分漂洗后剪成适当大小,封装于聚丙烯塑料袋,置4℃备用。
1.2 人脱细胞真皮基质(human acellular dermal matrix,hADM):购自北京桀亚莱福生物技术有限责任公司。临用前无菌状态下取出,PBS 冲洗3遍后备用。
1.3 人工真皮:Integra人工皮(简称 Integra)由美国Integra LifeScience公司惠赠。临用前揭去其表层硅膜。
1.4 真皮替代物性状:sADM与hADM在外观上大致相同,均呈磁白色,柔软,有一定弹性,但sADM韧性稍大,色泽微黄。Integra真皮面为海绵状,柔软,吸水性强。显微镜下可见sADM与hADM的结构相似,呈多孔隙、疏松、均质、淡红色为主的结构,但后者稍致密,在真皮表皮面可见薄层基底膜和波浪起伏的乳头结构。镜下见Integra呈淡红色条状疏松海绵状结构。
2. 真皮替代物移植:雌性SD大鼠(湖北省医院实验动物中心)21只,体重200~250g,根据其皮下埋植不同的真皮替代物分为sADM组、hADM组及Integra组,每组7只。术前2d用80g/L硫化钠脱毛。以30g/L戊巴比妥钠(35mg/kg)腹腔注射麻醉。于背部切开皮肤,在深筋膜与肌膜之间向一侧分离形成囊腔。分别植入5cm×5cm的各种真皮替代物,其四角各缝1针贯穿至皮外,结扎后留线作为后期取样标志。切口原位缝合并包扎,每日观察,10d左右拆除切口缝线。
3. 移植物大体观察及组织标本观察:术后动物分笼饲养。于移植后2、3、4、7、10、14、21、30、60、90、120、150、180d 行移植物大体观察,并以皮肤取样器取组织活检,HE及免疫组织化学染色后于镜下观察。30d后因体表缝线标记脱落,为确保取样准确,采用切开直视下取样。记录移植物的面积、厚度、质地及色泽变化。
二、结 果
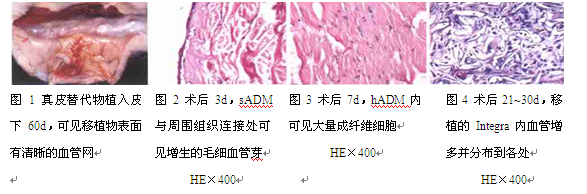
1. 大体观察:所有实验大鼠在麻醉复苏后即可自由活动,精神、食欲如常。术后创口周围皮肤无明显红肿及炎症反应,切口愈合良好,移植物与创面接触紧密。术后30-60d各组移植物质地稍硬,以sADM组与hADM组较明显,透过皮肤可以较容易地触及。术后60d切开取样检视时,可见埋入皮下的真皮移植物表面有丰富而清晰的血管网(图1)。90d后各组植入真皮质地较柔软,不易从体表触及。180d 时,各组均可检视到移植物的存在,其中部分有不同程度吸收退化,表现为面积缩小,厚度变薄等,个别甚至难以辨认。
2. 组织学观察:术后2d各组真皮替代物内可见成纤维细胞侵入,中性粒细胞、淋巴细胞及少量巨噬细胞浸润。第3天各移植物与周围组织连接处可见开始增生的细小新生毛细血管芽(图2)。7d时,各移植真皮内可见大量成纤维细胞侵入、增生,沿胶原纤维方向分布(图3);新生毛细血管向移植物内部延伸。术后14d各组ADM与受床周围组织界限清楚,组织内见较多成纤维细胞浸润和血管内皮细胞增生,新形成的毛细血管多分布于靠近受床组织处,少数达移植物内部;组织中有中性粒细胞、淋巴细胞及少量巨噬细胞浸润。术后21-30d,移植物内血管数量进一步增多,并分布到移植物内各处(图4)。术后30-60d移植物内均已建立丰富的血管网;60-120d各组真皮与受床的界线仍较清楚,原有疏松结构的空隙变小。术后120-150d,真皮替代物内的成纤维细胞数量减少、纤维排列及血管状况等基本稳定。术后150-180d,真皮替代物原有的疏松海绵状结构已逐步转变为与正常真皮类似的结构。免疫组织化学染色显示,兔抗鼠Vi mentin及CD31分别对成纤维细胞及血管内皮细胞阳性着色。hADM组与sADM组在移植后的血管化进程、成纤维细胞及血管内皮细胞的增生、迁移和数量变化上无明显区别。Integra组显示较hADM组与sADM组更利于成纤维细胞的侵入及与周围组织黏附。
三、讨 论
真皮是皮肤最重要的组成成分之一,它不仅提供了良好的机械缓冲作用,给皮肤以弹性、韧性和强度,更是表皮赖以附着的基础。一定厚度的真皮能减轻植皮区愈合后的创面收缩。移植皮肤中的真皮结构不仅可控制炎症反应和伤口收缩,还可激发移植后新生真皮的改建过程[4]。真皮主要由胶原、非胶原糖蛋白、弹力纤维、糖胺多糖及蛋白聚糖等细胞外基质成分组成,这些细胞外基质的物种间同源性很高,因此仅保留了部分细胞外基质的ADM移植后不易发生移植排异反应[5]。将ADM植入皮肤缺损创面,可充当一种真皮模板,引导自身的成纤维细胞、血管内皮细胞等向ADM内生长,分泌细胞外基质,形成新生血管,最后改造及重建真皮结构。采用同种、异种真皮或人工构建的真皮类似物作为真皮支架,在其上移植自体刃厚皮或培养表皮角质形成细胞,可形成具有相对完整功能的复合皮肤[6]。
本研究表明,来源于人体皮肤、猪皮及人工合成的3种不同真皮替代物埋植于实验大鼠皮下达180d,均未发生严重移植排异反应。成纤维细胞于移植后第2天即出现于移植真皮内,并随时间推移逐渐增加,所分泌的细胞外基质以原有真皮结构为支架,逐步充填改建形成实质性真皮结构。移植真皮的血管化过程自第3天就可观 察到,这早于既往研究报道[7]。此后毛细血管向真皮支架内侵入,数量逐步增加,于7-14d内已基本形成网状血管供应系统。这说明制作良好的同种、异种或人工真皮替代物移植后,血管化过程很快,其疏松的胶原网状结构有利于宿主的毛细血管向内长入。
有研究认为,ADM 的处理方式对其抗原性的消除有很大影响[6,8],因此如何进一步改进ADM的处理方式,最大限度保留有利于创面修复和表皮附着的成分(如表皮基底膜),同时尽可能减少远期吸收,仍值得进一步研究。
参 考 文 献
1. Srivastava A , Desagun EZ , Jennings LJ , et al. Use of porcine acellular dermal matrix as a dermal substitute in rats. Ann Sur g , 2001 ,233 :400 - 408.
2. Tal H , Moses O , Zohar R , et al. Root co verage of advanced gingival recession: a comparative study between acellular dermal matrix allograft and subepithelial connective tissue grafts. J Periodo ntol ,2002 ,73 :1405 - 1411.
3. Dantzer E,Braye FM. Reconstructive surgery using an artificial dermis(Inte- gra :results with 39 grafts. Br J Plast Surg ,2001 ,54 :659 - 664.)
4. Balasubramani M, Kumar TR, Babu M. Skin substitutes: a review.Burns, 2001,27 :534 - 544.
5. Lam PK , Chan ES , Yen RS , et al. A new system for the cultivation of keratinocytes on acellular human dermis with the use of fibrin glue and 3 T3 feeder cells. J Burn Care Rehabil , 2000 ,21 :1 - 4 .
6. Boyce ST. Design p rinciples for compo sitio n and performance of cultured skin substitutes. Burns ,2001 ,27 :523 - 533.
7. 姜笃银,陈璧,徐明达,等。异种脱细胞真皮基质的制作和临床应用观察。中华烧伤杂志,2002,18:15-18。
8. Walter RJ, Matsuda T, Reyes HM, et al. Characterization of acellular dermal matrices (ADMs) prepared by two different methods.Burns,1998,24:104-113.
(收稿日期:2003-12-22))
(本文编辑:张红)